Los gases son uno de los cuatro estados fundamentales de la materia. Se caracterizan por no tener forma ni volumen definidos, ya que se expanden para llenar completamente el recipiente que los contiene. Sus partículas están muy separadas y se mueven libremente, lo que les da propiedades como la compresibilidad, la expansión, la difusión y la baja densidad.
PROPIEDADES DE LOS GASES
¿QUÉ ES UN GAS?

Características de los gases
Los gases son uno de los cuatro estados fundamentales de la materia. Se caracterizan por no tener forma ni volumen definidos, ya que se expanden para llenar completamente el recipiente que los contiene. Sus partículas están muy separadas y se mueven libremente, lo que les da propiedades como la compresibilidad, la expansión, la difusión y la baja densidad.
Propiedades de los gases
-
Volumen (V):
El espacio que ocupa el gas. No es fijo; depende del recipiente. -
Presión (P):
Fuerza que ejercen las moléculas del gas al chocar contra las paredes del recipiente. -
Temperatura (T):
Relacionada con la energía cinética de las moléculas del gas. Se mide en kelvins (K) en las ecuaciones físicas. -
Densidad (ρ):
Masa por unidad de volumen. Es baja en los gases y puede cambiar con la presión y la temperatura. -
Compresibilidad:
Capacidad de reducir su volumen al aumentar la presión. Los gases son muy compresibles. -
Expansibilidad:
Tienden a expandirse y llenar completamente el recipiente donde se encuentran. -
Difusión:
Capacidad de mezclarse espontáneamente con otros gases. -
Efusión:
Paso de un gas a través de un pequeño orificio sin colisiones entre moléculas. -
Número de partículas (n):
Se expresa en moles y representa la cantidad de moléculas o átomos en el gas. -
Viscosidad (baja):
Resistencia al flujo. Los gases tienen menor viscosidad que los líquidos.

-
No tienen forma ni volumen definidos: Se expanden para llenar completamente el recipiente en el que se encuentran.
-
Alta compresibilidad: A diferencia de sólidos y líquidos, los gases pueden comprimirse fácilmente.
-
Gran capacidad de expansión: Se expanden para ocupar todo el espacio disponible.
-
Difusión: Se mezclan fácilmente con otros gases debido al movimiento aleatorio de sus partículas.
-
Baja densidad: Comparado con líquidos y sólidos, los gases tienen menor densidad.
-
Presión ejercida sobre las paredes del recipiente: El movimiento constante de las moléculas genera choques contra las paredes, lo que produce presión.

La presión atmosférica
La atmósfera, que es la capa de aire que envuelve nuestro planeta, ejerce una fuerza sobre cada unidad de superficie de los objetos que se encuentran dentro de ella. A esta fuerza se le conoce como presión atmosférica.
Para conocer el valor de esta presión se emplea un instrumento llamado barómetro, cuyo principio de funcionamiento se basa en el experimento realizado en 1643 por el físico italiano Evangelista Torricelli.
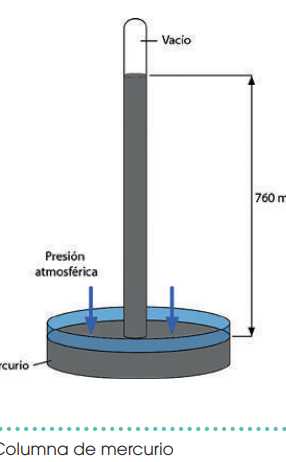
El experimento de Torricelli
El físico Evangelista Torricelli llevó a cabo un experimento en el que llenó un tubo de un metro de largo con mercurio y lo colocó invertido dentro de un recipiente que también contenía mercurio. Al hacerlo, observó que el mercurio no salía completamente del tubo, sino que permanecía una columna de 760 mm de altura.
Esto sucede porque la presión del aire sobre el mercurio en la cubeta impide que el contenido del tubo se vacíe del todo. La altura de esa columna de mercurio es una medida directa de la presión atmosférica.
A nivel del mar, esta presión se considera igual a 1 atmósfera (atm), lo cual equivale a 1,013 × 10⁵ pascales (Pa) o a 760 milímetros de mercurio (mm Hg).
En el Sistema Internacional (SI), la unidad de medida para la presión es el pascal (Pa). A continuación se presentan algunas equivalencias comunes: